微生物对人体的各种生理功能、疾病、衰老、情绪和认知的影响一直是人们关注的焦点。近年,肿瘤内驻留的微生物(TRIM)在恶性肿瘤的发生、发展及不良预后中的作用成为热点。TRIM可以从周围组织或者血液循环进驻肿瘤,降低化疗药物疗效,加重药物毒副作用,促进肿瘤细胞的生长和转移。然而,靶向杀伤TRIM对肿瘤免疫环境的影响以及其对长效抗肿瘤效果的影响尚不清楚。
临床对抗致病菌(包括TRIM)的常用策略是口服或者注射抗生素。由于缺乏靶向性,这类治疗可引起一系列不良反应,包括抑制肠道益生菌、破坏体内菌群平衡等。对恶性肿瘤患者,抗生素的使用还会影响免疫检查点抑制在抗肿瘤治疗中的有效性,并严重降低化疗疗效。实现对TRIM的靶向杀伤有望避免上述问题,但相关研究之前并未见报道。
除了传统的抗肿瘤疗法,近年来发展的各种新型治疗手段都显示出了明显的短期疗效。然而,残留的癌细胞或突变细胞仍然会导致肿瘤复发和转移,难以实现长效无复发和长生存期。有效激活不同类别恶性肿瘤的抗肿瘤免疫、恢复免疫监视、获得持久免疫记忆一直是抗肿瘤领域的难点。
针对TRIM在肿瘤区域引发的免疫抑制、肿瘤过度生长及恶性肿瘤高复发问题,bwin必赢国际官方网站于淼教授、孙晔教授团队与其合作者,通过靶向性瘤内抗菌结合多模抗肿瘤治疗,在不使用免疫刺激剂情况下,成功激活机体抗肿瘤免疫反应,恢复抗肿瘤免疫监视,实现长效免疫和对远端瘤体的有效抑制。治疗后,肿瘤无复发,小鼠存期大于700天,直至正常死亡,实现了恶性肿瘤的完全治愈。相关成果以《Long-term relapse-free survival enabled by integrating targeted antibacteria in antitumor treatment》为题,发表在国际知名学术刊物《自然通讯》(Nature Communications)上。

这项研究通过构建大肠杆菌 (E. coli) 侵染的乳腺癌 (4T1) 和前列腺癌 (RM-1) 肿瘤模型(两类高发恶性肿瘤,比口腔癌和结肠癌等与致病菌直接相关的肿瘤模型更具普遍性),证实了TRIM可以减少瘤内T细胞和M1-型巨噬细胞的数量,增加M2-巨噬细胞的数量,同时上调抗炎性细胞因子表达(如IL-10、TGF-β等),下调促炎性细胞因子表达(如IL-12、TNF-α、INF-γ等)。菌的存在不仅可以加重瘤内注射大肠杆菌的小鼠肿瘤区域的免疫抑制,而且在非无菌环境中饲养的小鼠肿瘤区域免疫抑制加重效果也非常明显。相较于无菌条件,其肿瘤生长速率都大幅增加(图1)。
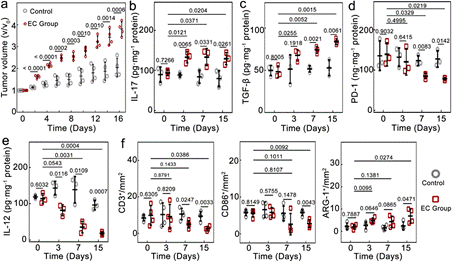
图1. TRIM促进小鼠乳腺癌免疫抑制和快速生长
对此,该团队设计并构建了Ag2Se包覆Au纳米制剂并用叶酸进行表面修饰 (Au@Ag2Se-FA NPs) (图2)。该单一纳米制剂可在实现光热、化学动力学和化疗多模肿瘤抑制的同时,实现TRIM靶向杀伤。该制剂具有高生物相容性,高的近红外光消光系数和光热转化效率。在近红外光照射下,短时间产生肿瘤局域高热消除癌症细胞;同时,Au@Ag2Se-FA原位还原Ag纳米晶体,进而释放Ag离子。Ag离子可以与肿瘤细胞内的过氧化氢发生类芬顿反应实现肿瘤特异性杀伤,而Au的催化作用和光热促进了反应。同时,Ag离子也可以作为化疗药物,并且可以实现强效抗菌。此外,类芬顿反应产生的羟基自由基的氧化还原作用和光热也可以进一步增强抗菌效果。

图2. Au@Ag2Se-FA NPs的表征与性能分析
通过抗菌-抗肿瘤联合,该方案有效解决瘤内菌引发的免疫抑制、肿瘤过度生长以及肿瘤复发问题 (图3)。在免疫抑制加重的情况下,有效激活T细胞免疫应答并促进M2-to-M1型巨噬细胞的复极化,恢复免疫监视。该方案对于对远端瘤同样有明显效果,并且可以引发长期抗肿瘤免疫记忆,实现恶性肿瘤的完全治愈 (小鼠无复发生存期> 700天,直至正常死亡)。
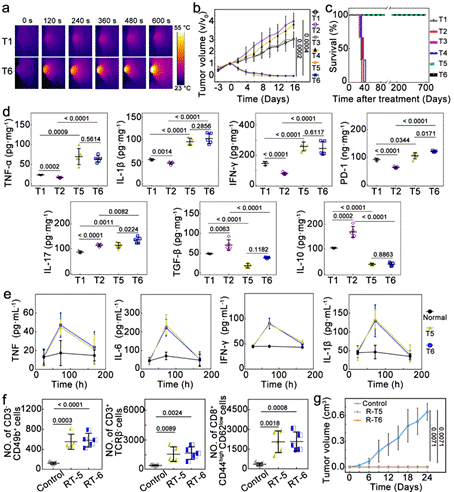
图3. 靶向瘤内菌抑制与抗肿瘤治疗联合
总结:这项工作揭示了靶向抗菌在肿瘤微环境免疫调节和肿瘤抑制中的关键作用,并且为在不使用免疫刺激药物的情况下有效激活抗肿瘤免疫开辟了一条新的途径。尽管免疫疗法在特定类型的恶性肿瘤中显示出可观前景,但在许多其他病例中疗效仍非常有限。这项工作的发现可能会对免疫疗法的无效性提供更深入的见解,并为临床肿瘤治愈带来革命性的新策略。
原文链接: https://doi.org/10.1038/s41467-024-48662-x


